5V高电压锂离子电池阴极材料研究进展
1 前言
本文引用地址:https://www.eepw.com.cn/article/177276.htm锂离子电池作为一种可多次重复充放电的能量储存技术,在过去20年来取得了非常重要的成功应用,尤其是作为各种可移动电子设备的动力源,促进了通信、电子等工业的蓬勃发展。如今,世界各国都努力试图将锂离子电池应用到汽车等运输工具中,以提供动力。丰田,福特等公司已经开发了多款混合动力源汽车,以减少汽油的使用。例如,丰田的Toyota Pirus混合动力汽车,因为使用锂离子电池作为辅助动力,每加仑汽油可行驶约50英里。现在,各国、各公司也都在大力投资试图率先开发出可靠安全的,唯一使用锂离子电池作为动力源的电动汽车。使用锂离子电池作为单一的动力源,要求锂离子电池能够储存/释放更高的能量、更长的重复充放电寿命、并且安全可靠。IBM发起的电池500项目,旨在开发出单次充电可行驶500英里(800km)的电池,即要求电池的能量容量约为125kWh[1]。这些应用也对电池材料提出了更高的要求,尤其是电池的阴极(正极)材料。相对于电池的负极(阳极)材料,阴极材料的容量普遍更低。石墨作为阳极材料容量接近约400 mAh/g,而广泛商用的阴极材料LiCoO2只有约140 mAh/g的可利用充放电容量,LiFePO4约160 mAh/g。电池的能量密度约为电池放电电压和容量的乘积,因此,除提高阴极材料容量外,提高阴极材料相对于Li/Li+电极的电势,是另一个提高电池能量密度的有效途径。LiCoO2相对Li/Li+电极的放电电压约为4V,若与5V相同容量的阴极材料相比,电池能量密度可提高约25%。因此,近来5V高电压阴极材料的研究开发,也取得了众多研究者越来越多的关注。具有类尖晶石晶体结构的LiNi0.5Mn1.5O4、和类橄榄石晶体结构的LiMPO4(M=Co,Ni)的两类材料为最有开发潜力的5V高电压阴极材料。本文将系统地阐述5V高电压阴极材料所面临的问题,以及取得的最新进展。
2 5V高电压阴极材料面临的问题
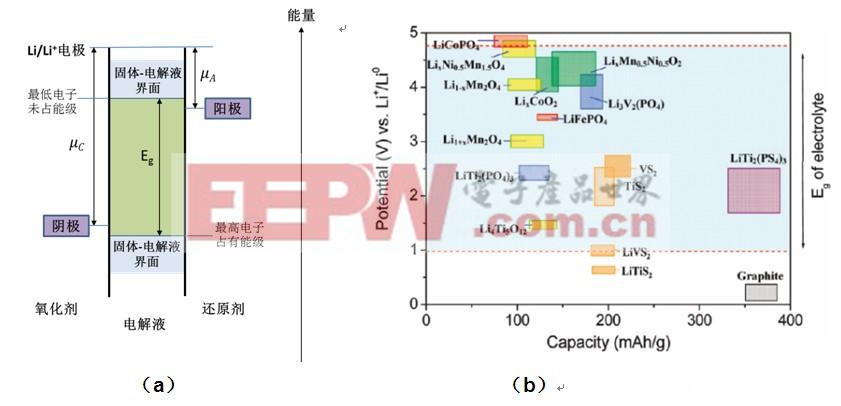
图1(a)示意地说明了电池热力学稳态时阴极、阳极和电解液的电子能级。以Li/Li+电极为参比电位,μA为阳极材料的相对电化学势,μC为阴极材料的电化学势,电解液电势窗口Eg为电解液最低电子未占能级和最高电子占有能级之差。以阴极和阳极组成电池时,μC和μA的差为电池的开路电压。当阳极和阴极的电化学势在电解液的最低电子未占能级和最高电子占有能级之间时,电解液能很好的工作。但当阳极材料的电化学势高于最低电子未占能级时,阳极材料的电子会被电解液夺取,因而电解液被氧化,反应产物在阳极材料颗粒表面形成固液界面层;类似地,当阴极材料的电化学势低于最高电子占有能级时,电解液中的电子被阴极材料取得,从而氧化电解液,在阴极颗粒表面形成固液界面层。但是,当阴阳极电化学势略在Eg范围之外时,一些固液界面层能阻挡电子在电解液和阴(阳)极间的进一步输运,从而阻止进一步的反应,保护电极材料。例如,石墨相对Li/Li+电极的电化学势约为0.2V,在电解液(1M LiPF6 溶于EC:DEC)的电势窗口Eg范围之外(1 V~4.5V)。但是,因为EC能形成保护性的固液界面层,从而使得电解液不被进一步还原,所以石墨能成功应用为锂电池的阳极材料。现在商用的有机电解液为1M LiPF6溶于EC:DEC或EC:DMC,其电势窗口Eg范围约为1V~ 4.5V。然而,5V高电压阴极材料已经接近或者超出了现在商用有机电解液的电势窗口,因而电解液在充放电过程中极易被氧化,形成固液界面层,随着充放电循环次数的增加,容量大大降低,循环寿命减小。图1(b)示意的说明了一些电极材料的充放电电势与商用有机电解液电势窗口Eg的相对关系[2]。类尖晶石晶体结构LiNi0.5Mn1.5O4和类橄榄石晶体结构LiCoPO4的电势接近甚至超出Eg。因此,寻找与LiNi0.5Mn1.5O4和LiCoPO4相匹配的电解液,或者对其保护性表面改性开发成为现今改进5V高压阴极材料主要的研究途径。
图1 电解液电势窗口与电极活性材料氧化还原势的相对关系。(a)电解液电化学势窗口示意图。(b)常用电极材料电势与有机电解液(1M LiPF6 溶于EC:DEC)的电化学势窗口间的相对关系[2]。
3 5V高电压阴极材料研究进展
在类尖晶石结构的LiMn2O4中掺杂阳离子(Fe,Co,Ni等)可提高电势,在4V和5V左右会分别出现两个放电平台[3]。这些掺杂体系中,LiNi0.5Mn1.5O4具有约4.7V的放电电势和约130mAh/g的容量(理论容量达147 mAh/g)[4],最具开发潜力。而和LiFePO4具有相似结构的LiCoPO4和LiNiPO4,分别具有4.8V,和5.2V的放电电势,且理论容量都接近170 mAh/g[5],因而也受到了很多的关注。
3.1 LiNi0.5Mn1.5O4
3.1.1 掺杂
在LiNi0.5Mn1.5O4中掺杂阳离子或者阴离子是提高LiNi0.5Mn1.5O4化学稳定性,进而提高循环充放电性能的有效途径。加入的微量替换离子能在颗粒表面聚集,减少表面的反应活性更高的Ni离子,从而减少表面的有害反应并抑制固液界面的形成,因此提高LiNi0.5Mn1.5O4的快速充放电性能和循环稳定性。
Ooms等人[6]发现,掺杂Mg能提高LiNi0.5Mn1.5O4的结构稳定性。通过溶胶-凝胶法和固态反应制备的LiMgxNi0.5-xMn1.5O4(x0.1),在0.1C速率下充放电容量接近理论值(大于120 mAh/g)。Locati等人[7]制备的纳米级LiMg0.05Ni0.45Mn1.5O4,在室温下具有约10-6 S/cm的电导率,从而具有良好的快速充放电性能,0.1C速率下容量为131 mAh/g,1C速率下容量为117 mAh/g。
Liu等人[8]制备了掺杂不同含量Fe的LiMn1.5Ni0.42Fe0.08O4,LiMn1.42Ni0.42Fe0.16O4,和 LiMn1.5Ni0.34Fe0.16O4。未掺杂LiNi0.5Mn1.5O4的在C/6速率下容量为?130 mAh/g,循环50次后容量保持为92%;而掺杂Fe的LiMn1.5Ni0.42Fe0.08O4,LiMn1.42Ni0.42Fe0.16O4,和 LiMn1.5Ni0.34Fe0.16O4容量分别为136,131,和127 mAh/g,且100次循环后容量仍保留100%。电化学阻抗谱(EIS)显示掺杂Fe后,表面阻抗降低;X射线光电子能谱(XPS)显示表面的Fe含量高于芯部,而表面的Ni含量低于芯部,Fe相比于Ni具有更低的反应活性,因而抑制了有害反应和固液界面层的形成。
Co也是报道较多的一种有效掺杂元素[9-12]。Oh等人[11]制备了Co掺杂Li[Ni0.5Co0.05Mn1.45]O4,其放电容量在5C速率时达118 mAh/g,10C速率时为103 mAh/g;而未掺杂在5C和10C速率下放电容量仅分别为100 mAh/g和10 mAh/g。
掺杂Cr也能有效地提高LiNi0.5Mn1.5O4的电化学性能。Liu等人[13]用溶胶凝胶法制备LiCr0.1Ni0.4Mn1.5O4,并获得更好的高速充放电性能和循环性能。Arunkumar等人[14]制备的LiMn1.5-0.5yNi0.5-yCryO4在4.2-5V容量为128 mAh/g,且50次循环后保留98%的容量,均高于未掺杂的LiNi0.5Mn1.5O4(118 mAh/g,50次循环后容量保留92%)。最近,Aklalouch等人[15]制备的650 纳米大小的单晶LiMn1.4Ni0.4Cr0.2O4在1C的速率下容量可达142 mAh/g,高达60C的速率下25oC温度下放电容量仍可达到131 mAh/g,55℃时容量为123 mAh/g,且55℃下循环50次循环后容量保留98.7%。
Ti[16-18]和Ru[19]也被发现可提高的高速充放电性能和循环性能。Kim等人[17]发现掺杂Ti能提高充放电电压、提高锂离子扩散速率、并获得更好的高速充放电性能。Wang等人[19]制备的Ru掺杂Li1.1Ni0.35Ru0.05Mn1.5O4和LiNi0.4Ru0.05Mn1.5O4比未掺杂LiNi0.5Mn1.5O4具有更好的高速充放电性能和循环性能。Li1.1Ni0.35Ru0.05Mn1.5O4和LiNi0.4Ru0.05Mn1.5O4在10 C的放电容量分别为108 mAh/g和117 mAh/g,且500次循环后仍能分别保留91%和84%的容量。
除了掺杂上述阳离子替代部分Ni或者Mn之外,掺杂氟离子以替代部分氧离子也可大大提高LiNi0.5Mn1.5O4的电化学性能[20-22]。在电解液中由于微量HF的存在而与电极材料发生反应,溶解部分Ni或者Mn离子,恶化电化学性能,而掺杂氟离子则可有效的抑制这种破坏反应。Xu等人[22]制备的掺杂氟LiNi0.5Mn1.5O3.975F0.05在3.5V-5.2V间充放电容量为140 mAh/g,高于未掺杂的130 mAh/g,且40次循环后容量保留为95%。
3.1.2 涂层
由于LiNi0.5Mn1.5O4具有的高充放电电压,其与电解液之间发生的反应会氧化电解液形成固液界面层,同时电解液中的HF会溶解部分Ni和Mn离子,从而使得电极材料的充放电容量下降,循环性能恶化。表面改性或表面涂层是研究较多的一种改善活性材料性能的有效手段。在活性材料颗粒表面形成氧化物(MOx)或者金属磷酸物(MxPO4),能有效的一方面能提供一层物理阻碍膜避免电解液与活性颗粒的直接接触;另一方面氧化物能与电解液中的HF发生反应而消耗掉HF,减少HF对活性颗粒的攻击。金属氧化物涂层ZnO[23-24],ZrO2[25],Al2O3[26]等能有效的提高LiNi0.5Mn1.5O4的电化学性能。表面具有ZnO涂层的LiNi0.5Mn1.5O4容量达到137 mAh/g,且在55℃温度下50次循环后几乎没有容量的下降[23]。Liu等人[26]在LiMn1.42Ni0.42Co0.16O4表面分别涂覆较均匀的约10 nm厚度的Al2O3,Bi2O3,ZnO,AlPO4,均能大大提高快速充放电性能和循环充放电性能。由于电解液中微量水分的存在而提供H+形成HF,HF与活性颗粒的反应会进一步的产生水分,从而使性能大大恶化,而氧化物的涂层能消耗HF且抑制固液界面层的形成,从而提高性能。Li3PO4[27]也被报道能提高LiNi0.5Mn1.5O4的高速充放电性能和循环性能。Li3PO4除了作为物理保护膜外,本身即是固液界面层,因而提高了LiNi0.5Mn1.5O4的电化学性能。
使用涂层改进活性颗粒的电化学性能也有局限之处。一方面,表面涂层增加了活性材料制备的工序,从而增加了电极材料制备的成本;另一方面,很难在亚微米级或者甚至纳米级的活性颗粒表面形成均匀的完全覆盖的保护性表面涂层。相比而言,掺杂手段则更容易制备且不引进复杂的制备工序。
3.2 LiMPO4(M= Co,Ni)
类橄榄石晶体结构的LiMPO4(M= Co,Ni),也是一类极具开发潜力的高电压电极材料。LiNiPO4具有最高的充放电电压,约为~5.2V,但目前还尚未开发出能与之匹配的电解液,因而还未见LiNiPO4在5.2 V充放电的电化学性能的相关报道。Manickam等人[28]使用LiOH水溶液作为电解液,Hg/HgO作为参比电极,Sn作为反电极,从而在较低电势下(对比Sn在~1.5V充电,~0.5放电)得出了LiNiPO4的充放电曲线。
LiCoPO4具有4.8V的充放电电压,具有相对较多的研究报道。尽管在目前的通用电解液体系下能得出LiCoPO4的电化学性能,但其循环充放电性能极差。与LiNi0.5Mn1.5O4相似,在高电压下充放电会使得LiCoPO4与电解液发生反应,形成固液界面层,并部分溶解Co离子,大大恶化其循环充放电性能。同时,类橄榄石晶体结构具有极低的电导性能,因而其快速充放电性能也很差。与LiFePO4相似,纳米化、掺杂、和非晶碳涂层是三种提高其性能的手段。纳米级的小颗粒相比微米大颗粒,具有更短的锂离子和电子传输扩散路径,且具有更大的比表面积。掺杂阳离子则能提高其电导性。非晶碳涂层能形成相互连接的电子高速传输通道,从而提高性能。
Sun等人[29]制备出Co(OH)2,再进行固态反应制备出200nm~400nm左右的具有非晶碳表面涂层的LiCoPO4,其在0.2C的速率下第一次放电容量为108.9 mAh/g。Li等人[30]用微波加热反应的办法制备出约150nm大小的具有非晶碳涂层的纳米LiCoPO4颗粒,在3V~5.1 V间首次放电容量达144 mAh/g,30次循环后容量仍未72.6 mAh/g,而无非晶碳涂层的LiCoPO4容量分别仅为93.3 mAh/g和19.4 mAh/g。Wang等人[31]利用热水法制备出刺猬状的具有非晶碳涂层的LiCoPO4,约20nm直径的LiCoPO4纳米线自组装成球状颗粒,首次放电容量达136 mAh/g,且50次循环后保留有约91%的容量。Liu等人[32]用喷射热解法制备出中空的具有非晶碳涂层的球状LiCoPO4颗粒,颗粒大小约70nm,在0.1C速率下放电容量为123 mAh/g,20次循环后保留有97%的容量。
除纳米化和碳涂层外,研究者也试图利用掺杂、使用电解液添加剂等办法提高LiCoPO4的电化学性能。Jang等人[33]制备掺杂Fe的Li1.02(Co0.9Fe0.1)0.98PO4,并进一步在其表面制备LiFePO4涂层,首次放电容量为122 mAh/g,且20次后容量保留70%。Allen等人[34]制备出掺杂有Fe的Li0.92Co0.8Fe0.2PO4,并在电解液中添加1% HFiP,在2.5V~5.3 V间充放电循环10次后容量保留100%,循环500次后容量仍保留80%。Sharabi等[35]使用具有SiO2的分隔层,获得了较好的循环性能。可能的原因为分隔层中SiO2能消耗电解液中的微量HF,从而提高循环性能。Xie[36]等人尝试用固态Li1+x+yAlxTi2-xSiyP3-yO12 (LATSP)作为电解液和分隔层,在LATSP上沉积一层LiCoPO4薄膜,且获得了电化学性能。尽管固态LATSP具有很高的电化学势窗口,但其Li离子扩散系数很低,且不能与活性材料颗粒具有很好的接触,所以使用其作为电解液材料还需要进一步的实验开发。
4 展望
总的来讲,5V高电压阴极材料因其更高的能量密度,具有更大的开发潜力和市场前景,尤其是在需要提供高电压高能量的应用中,例如对于电动汽车电池,高电压阴极材料意味着串联更少的单电池、更小的总电池体积和更轻的电池质量、以及更高的能量。随着近些年来不断的研究提高,5V高电压阴极材料会在不久的几年内进入市场,尤其是具有类尖晶石结构的LiMn1.5Ni0.5O4,兼具高电压和良好的循环性能。然而对于类橄榄石结构的LiMPO4(M=Co,Ni),尽管具有更高的理论容量,但其循环性能仍需要极大的提高才能有好的应用前景。
参考文献
[1] Girishkumar, G., et al., Lithium - Air Battery: Promise and Challenges[J]. Journal of Physical Chemistry Letters, 2010. 1(14): p. 2193-2203.
[2] Goodenough, J.B. and Y. Kim, Challenges for Rechargeable Li Batteries[J]. Chemistry of Materials, 2010. 22(3): p. 587-603.
[3] Amine, K., et al., Preparation and electrochemical investigation of LiMn2-xMexO4 (Me : Ni, Fe, and x=0.5, 1) cathode materials for secondary lithium batteries[J]. Journal of Power Sources, 1997. 68(2): p. 604-608.
[4] Shin, Y. and A. Manthiram, Origin of the high voltage (> 4.5 V) capacity of spinel lithium manganese oxides[J]. Electrochimica Acta, 2003. 48(24): p. 3583-3592.
[5] Howard, W.F. and R.M. Spotnitz, Theoretical evaluation of high-energy lithium metal phosphate cathode materials in Li-ion batteries[J]. Journal of Power Sources, 2007. 165(2): p. 887-891.
[6] Ooms, F.G.B., et al., High-voltage LiMgδNi0.5?δMn1.5O4 spinels for Li-ion batteries[J]. Solid State Ionics, 2002. 152-153(0): p. 143-153.
[7] Lafont, U., et al., Nanosized high voltage cathode material LiMg0.05Ni0.45Mn1[J].5O4: Structural, electrochemical and in situ investigation. Journal of Power Sources, 2009. 189(1): p. 179-184.
[8] Liu, J. and A. Manthiram, Understanding the Improved Electrochemical Performances of Fe-Substituted 5 V Spinel Cathode LiMn1.5Ni0.5O4[J]. The Journal of Physical Chemistry C, 2009. 113(33): p. 15073-15079.
[9] Li, D., et al., Structural and electrochemical characteristics of LiNi0.5?xCo2xMn1.5?xO4 prepared by spray drying process and post-annealing in O2[J]. Journal of Power Sources, 2006. 161(2): p. 1241-1246.
[10] Arunkumar, T.A. and A. Manthiram, Influence of Lattice Parameter Differences on the Electrochemical Performance of the 5 V Spinel LiMn[sub 1.5 - y]Ni[sub 0.5 - z]M[sub y + z]O[sub 4] (M = Li, Mg, Fe, Co, and Zn)[J]. Electrochemical and Solid-State Letters, 2005. 8(8): p. A403-A405.
[11] Oh, S.W., et al., Effects of Co doping on Li[Ni0.5CoxMn1.5?x]O4 spinel materials for 5#xa0;V lithium secondary batteries via Co-precipitation[J]. Journal of Power Sources, 2009. 189(1): p. 752-756.
[12] Ito, A., et al., Influence of Co substitution for Ni and Mn on the structural and electrochemical characteristics of LiNi0.5Mn1.5O4[J]. Journal of Power Sources, 2008. 185(2): p. 1429-1433.
[13] Liu, G.Q., et al., Rate capability of spinel LiCr(0.1)Ni(0.4)Mn(1.5)O(4)[J]. Journal of Alloys and Compounds, 2010. 501(2): p. 233-235.
[14] Arunkumar, T.A. and A. Manthiram, Influence of chromium doping on the electrochemical performance of the 5 V spinel cathode LiMn1.5Ni0.5O4[J]. Electrochimica Acta, 2005. 50(28): p. 5568-5572.
[15] Aklalouch, M., et al., Sub-micrometric LiCr(0.2)Ni(0.4)Mn(1.4)O(4) spinel as 5 V-cathode material exhibiting huge rate capability at 25 and 55 degrees C[J]. Electrochemistry Communications, 2010. 12(4): p. 548-552.
[16] Alcantara, R., et al., Structural and electrochemical study of new LiNi0.5TixMn1.5-xO4 spinel oxides for 5-V cathode materials[J]. Chemistry of Materials, 2003. 15(12): p. 2376-2382.
[17] Kim, J.H., et al., Effect of Ti substitution for Mn on the structure of LiNi0.5Mn1.5-xTixO4 and their electrochemical properties as lithium insertion material[J]. Journal of the Electrochemical Society, 2004. 151(11): p. A1911-A1918.
[18] Liu, G.Q., et al., The electrochemical properties of LiNi(0.5)Mn(1.2)Ti(0.3)O(4) compound[J]. Journal of Alloys and Compounds, 2009. 484(1-2): p. 567-569.
[19] Wang, H.L., et al., Enhancements of rate capability and cyclic performance of spinel LiNi(0.5)Mn(1.5)O(4) by trace Ru-doping[J]. Electrochemistry Communications, 2009. 11(7): p. 1539-1542.
[20] Oh, S.W., et al., Improvement of electrochemical properties of LiNi0.5Mn1.5O4 spinel material by fluorine substitution[J]. Journal of Power Sources, 2006. 157(1): p. 464-470.
[21] Du, G.D., et al., Fluorine-doped LiNi(0.5)Mn(1.5)O(4) for 5 V cathode materials of lithium-ion battery[J]. Materials Research Bulletin, 2008. 43(12): p. 3607-3613.
[22] Xu, X.X., et al., LiNi0.5Mn1.5O3.975F0.05 as novel 5 V cathode material[J]. Journal of Power Sources, 2007. 174(2): p. 1113-1116.
[23] Sun, Y.K., et al., Electrochemical performance of nano-sized ZnO-coated LiNi0.5Mn1.5O4 spinel as 5 V materials at elevated temperatures[J]. Electrochemistry Communications, 2002. 4(4): p. 344-348.
[24] Sun, Y.K., C.S. Yoon, and I.H. Oh, Surface structural change of ZnO-coated LiNi0.5Mn1.5O4 spinel as 5 V cathode materials at elevated temperatures[J]. Electrochimica Acta, 2003. 48(5): p. 503-506.
[25] Wu, H.M., et al., Surface modification of LiNi(0.5)Mn(1.5)O(4) by ZrP(2)O(7) and ZrO(2) for lithium-ion batteries[J]. Journal of Power Sources, 2010. 195(9): p. 2909-2913.
[26] Liu, J. and A. Manthiram, Understanding the Improvement in the Electrochemical Properties of Surface Modified 5 V LiMn(1.42)Ni(0.42)Co(0.16)O(4) Spinel Cathodes in Lithium-ion Cells[J]. Chemistry of Materials, 2009. 21(8): p. 1695-1707.
[27] Kobayashi, Y., et al., 5 V class all-solid-state composite lithium battery with Li(3)PO(4) coated LiNi(0.5)Mn(1.5)O(4)[J]. Journal of the Electrochemical Society, 2003. 150(12): p. A1577-A1582.
[28] Minakshi, M., et al., Synthesis and characterization of olivine LiNiPO(4) for aqueous rechargeable battery[J]. Electrochimica Acta, 2011. 56(11): p. 4356-4360.
[29] Sun, Q., J.Y. Luo, and Z.W. Fu, Facile Synthesis and Electrochemical Properties of Carbon-Coated LiCoPO(4) Submicron Particles as Positive Materials for Lithium Ion Batteries[J]. Electrochemical and Solid State Letters, 2011. 14(10): p. A151-A153.
[30] Li, H.H., et al., Fast synthesis of core-shell LiCoPO(4)/C nanocomposite via microwave heating and its electrochemical Li intercalation performances[J]. Electrochemistry Communications, 2009. 11(1): p. 95-98.
[31] Wang, F., et al., Novel hedgehog-like 5 V LiCoPO(4) positive electrode material for rechargeable lithium battery[J]. Journal of Power Sources, 2011. 196(10): p. 4806-4810.
[32] Liu, J., et al., Spherical nanoporous LiCoPO(4)/C composites as high performance cathode materials for rechargeable lithium-ion batteries[J]. Journal of Materials Chemistry, 2011. 21(27): p. 9984-9987.
[33] Jang, I.C., et al., LiFePO(4) modified Li(1.02)(Co(0.9)Fe(0.1))(0.98)PO(4) cathodes with improved lithium storage properties[J]. Journal of Materials Chemistry, 2011. 21(18): p. 6510-6514.
[34] Allen, J.L., T.R. Jow, and J. Wolfenstine, Improved cycle life of Fe-substituted LiCoPO(4)[J]. Journal of Power Sources, 2011. 196(20): p. 8656-8661.
[35] Sharabi, R., et al., Significantly improved cycling performance of LiCoPO(4) cathodes[J]. Electrochemistry Communications, 2011. 13(8): p. 800-802.
[36] Xie, J., et al., Li-ion diffusion kinetics in LiCoPO(4) thin films deposited on NASICON-type glass ceramic electrolytes by magnetron sputtering[J]. Journal of Power Sources, 2009. 192(2): p. 689-692.■
电化学工作站相关文章:电化学工作站原理 离子色谱仪相关文章:离子色谱仪原理



评论