固体氧化物燃料电池的效率分析
自从人类进入工业化礼会以来,人类利用化石能源的途径仍然是首先将化学能转变为热能,再转变为机械能,再通过机械能转变为电能。由于热能转变为机械能过程受到卡诺定理的限制,所以目前的能量效率非常低下。如果能够提高化石燃料的效率,那么提供相同机械能或者电能所需要的化石燃料量将会减少,同时向大气中排除的CO2量也会减少,达到节约能源和保护环境的口的:
本文引用地址:https://www.eepw.com.cn/article/90005.htm燃料电池作为一种能量转换装置,能够直接将燃料中的化学能转变为电能,并且不受卡诺定理的限制。与传统发电装置相比,燃料电池具有效率高、污染低、噪音低、可靠性高等特点。并且燃料电池对气体中燃料含量要求不高,甚至在非常低的燃料含量下仍然可心工作。与质子交换膜燃料电池(PEMFC)相比,同体氧化物燃料电池(SOFC)不仪可以使用H2作为燃料,还可以使用其他气体(如甲烷等)作为燃料,并且一些在常温下是液态的燃料也是其潜在的燃料来源;与熔融碳酸盐燃料电池(MCFC)相比,SOFC使用固体电解质,将没有或者只有少量的腐蚀存在。因此在所有燃料电池技术中,SOFC由于其独特的优点受到很多研究机构的关注。
尽管SOFC具有很高的理论能量转换效率,但是目前报道的实际SOFC单体性能远不能达到理论转换效率。本文将从热力学埋论及实验数据开始分析影响SOFC效率的因素,并提出相应的改进方法,对SOFC的进一步发展提供理论依据。
1 SOFC的效率计算
1.1 SOFC的热力学理论效率
对于燃料电池,以化学反应热焓的减少(-△H)来代表输入能量,以吉布斯自由能的减少(-△G)作为获得的最大电能。于是对于任何燃料电池体系的热力学效率可以用式(1)表示:
![]()
标准状态下燃料气体氧化反应的吉布斯自由能变(△G)和焓变(△H)呵以查找相关手册,表1列出一些常见燃料电池用生物质气体反应的热力学数据。从表1中可以看出燃料电池的热力学效率非常高,而热机由于受到卡诺定理的限制即使在800℃其热力学效率只有46%,说明燃料电池发电具有很大的效率优势。
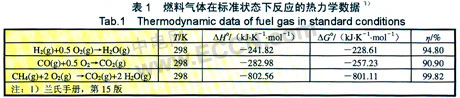
而由于SOFC通常在高温(600~1 000℃)环境下工作,同时在计算不同温度的△G时非常不方便,所以在高温下SOFC的热力学理论效率可以利用式(2)进行计算:
![]()
其中热焓(△H)和熵(△S)都是温度的函数,不同温度时化学反应的△H和△S可以通过式(3)和式(4)计算得到。在式(3)和式(4)中,△Cp是气体等压热容差,计算方法如式(5)。在式(5)中,Cp是气体的等压热容,可以查找手册得到不同温度下的等压热容差值,再通过插值或者线性拟合就可以得到△Cp与温度T的函数关系;β是表1中方程的配位系数,其中反应物为负值,生成物为正值。将式(3)~(5)代人式(2)得式(6)就可以计算出不同温度下燃料气体在燃料电池中的热力学效率。
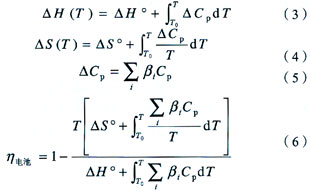
图1列举了主要SOFC用燃料气体(H2、CO和CH4)在不同温度下的热力学理论效率。从图中可以看出,低温(<650℃)时燃料电池的理论电效率均高于70%,而热机发电由于受到卡诺定理的限制其效率远低于此值,可见SOFC具有非常高的理论电效率优势。
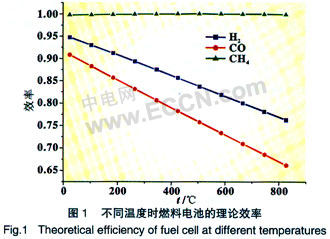
以H2和CO为燃料时SOFC热力学理论效率均随温度的升高而降低,并且当温度高于800℃后,SOFC的热力学理论效率与热机相比已经没有很大的优势,所以理论上应该发展低温SOFC。
以CH4为燃料时SOFC效率随温度的升高而升高,并且在一定温度下高于100%,产生这种现象的原因是由于所研究的系统已经不是一个封闭系统,根据能量守恒定理,此时系统必须向环境吸收能量。根据这个现象,可以使用CH4与H2和CO的混合气体作为燃料,这样可以得到比使用单一气体为燃料时更高的效率,并且当CH4含量达到一定值后,即使在高温条件下,系统热力学理论效率也将高于80%。
1.2 SOFC的实际效率
实际过程中定义SOFC的效率为输出电能与进入电池的燃料热焓之比,见式(7),其中,I、V分别是电池的输出电流和电压。
![]()
表2列出了部分以H2为燃料的SOFC达到最大比功率时的电池效率,在计算过程中假设电解质只有离子电导,没有漏气和电子电导等现象。
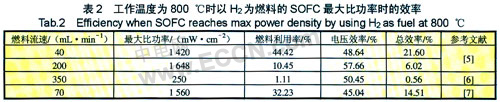
从表2中数据可以看出,在最大比功率时的SOFC效率不仅远比理论效率低,而且比当前内燃机的发电效率都低,可见目前的研究离SOFC真正实用化还有一定的距离。因此SOFC走向实用化还需要提高其效率。
为了提高SOFC的效率,可以从影响SOFC效率的因素出发,即可对式(7)进行变形:
![]()
式(8)中△G/△H就是燃料电池的热力学效率η热力学。n为1 mol燃料在氧化反应过程中消耗的摩尔电子数,V是电池工作过程中的输出电压,I是输出电流,F是法拉第常数,ηg是燃料的利用率,△G/nF是电池的热力学电动势E,所以V/(△G/nF)就是SOFC的电压效率;IT/(ηgnF)加就是SOFC的电流效率,所以SOFC的实际效率应该为热力学效率η热力学,电压效率ηV,电流效率ηI和燃料利用率ηg的积:
![]()
SOFC的开路电压反应了电池电解质内离子导电与电子导电之比,从而反应了电池的电流效率。据报道使用不同的电解质时开路电压有很大的差异,这是由于不同电解质的离子电导率和电子电导率之比不同。例如使用LSGM和YSZ电解质时,由于较高的离子电导率与电子电导率之比,所以开路电压较高;使用掺杂CeO2电解质时,在高温(>500 ℃)还原气氛下Ce4+被还原成Ce3+促进了电解质电子电导,使得开路电压较低。Fu等在GDC电解质中掺杂LiCl和SrCl2后得到的OCV接近理论值,说明掺杂卤盐可以抑制掺杂CeO2电解质在高温下的电子电导;还有学者使用复合电解质抑制CeO2在高温下的电子电导。从单体电池性能测试图可以看出,随着电流密度的增加,电压持续下降,也就是电池的电压效率下降。根据电化学原理,任何一个电极反应随着反应速率的增加,其极化作用相应的增强,消耗在电极上的能量增加,导致电池的输出效率降低。对于任何一个电极反应速率常数可以使用式(10)表示,式(10)中△G是电极反应的活化能,R是气体常数,T是反应温度。从式(10)可以看出,提高电极的反应温度,就可以提高电极反应的速率,增加电极的去极化作用,从而提高电池的电压效率。
![]()
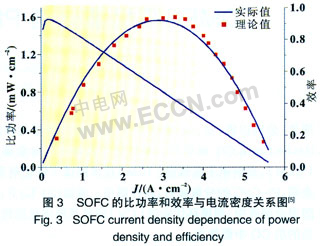
同时考虑到SOFC的极化电阻和电解质电子导电特性,建立SOFC导电模型(图2),其中E是电池的电动势,RA和RC分别是电池的阳极和阴极电阻,ηA和ηC分别是阳极和阴极反应势垒;RE是电解质氧离子导电电阻;Ri是电解质电子导电电阻;Ro足外电路电阻。电阻都是使用比面积电阻表示。以氢气为燃料,当H2速率较高时,模型与文献[5]实验结果匹配较好(图3)。
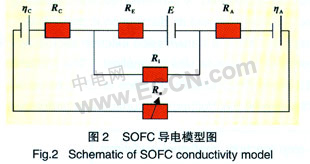
由图2 可知,在SOFC工作过程中,电池的电流效率可以使用式(11)表示:
![]()
由式(11)可以看出,降低SOFC内电解质的电子电导率及降低阳极和阴极的极化电阻可以有效地提高SOFC的电流效率。从文献[11]可以知道,随着温度的降低,SOFC的极化加剧,当温度从700℃降低到550℃时,电极(阴极和阳极)的极化电阻增加了1倍,导致SOFC的效率降低。因此,在实际应用过程中,SOFC必须工作在很高温度下。
在SOFC工作过程中,电压效率和电流效率是相互影响的,因此定义功牢效率ηp=ηvηI。根据图2模型得到的SOFC的功率效率和比功率的父系见图3,图中可以看出开始随着比功率的增大SOFC的效率升高,到达最大值后效率持续下降。可以得出对于任何SOFC系统,都可以存一定的电流密度下获得最大比功率。
燃料利用率与燃料流速,阳极结构和温度有很大的联系。Katsuhiko Yamaji等在不同燃料流速的情况下,将电池电压控制在500 mV,得到燃料流速越高,燃料利用率越低。从表2也可以看出,燃料速率不同,获得的燃料利用率也不同。Sauvet等研究以La1-xSrxCr1-yNiyO3(LSCN)为阳极催化甲烷时发现,当Sr含量与Ni含量变化,而其他条件不变时,LSCN的催化效率发生变化。同时提高系统温度可以增加燃料的热运动以及提高燃料的氧化反应速率,从而提高燃料的利用率。
2 结果与展望
SOFC是一种理想的能量转化装置,能够以很高的效率将燃料中的化学能直接转变为电能,但是实际过程中SOFC效率远达不到其热力学理论效率。影响SOFC效率的因素有电压效率、电流效率和燃料利用率。提高温度可以提高SOFC的电压效率、电流效率和燃料利用率,但是提高温度将降低SOFC的热力学理论效率。存SOFC研究过程中,工作温度的选择也是今后研究的课题。
离子色谱仪相关文章:离子色谱仪原理






评论