JMP Clinical of SAS帮助FDA及SFDA改进药物评审
据悉,继美国食品与药物管理局(FDA)正式使用JMP Clinical of SAS之后,中国食品药品监督管理局(SFDA)也正式开始使用JMP Clinical产品,用于新药评审环节的数据分析及其他相关生物统计应用。
本文引用地址:https://www.eepw.com.cn/article/136562.htmJMP Clinical 是SAS公司应FDA的要求于2010年正式推出的新一代生命科学数据分析平台,特别适用于药物临床试验数据的分析。它推出后,成为SAS公司JMP产品系列继JMP,JMP Pro,JMP Genomics之后的第四个主要产品,它可以帮助简化临床试验数据的安全性评审,缩短昂贵而繁琐的药物开发过程。
据了解,美国FDA的评审员在药物审评中广泛使用JMP多年,目前有超过40%的评审员在使用该系列软件进行数据审查和分析,包括对制药企业提交的新药申请报告进行评审。目前,FDA在评审环节中,对于非数据的部分,主要借助Microsoft Office及PDF等软件进行评审,而对于数据,则主要使用JMP、JMP Clinical和SAS。而SAS软件早已是生命科学数据分析领域事实上的标准软件,JMP、JMP Clinical和SAS都已经被全球各大药厂在化合物发现、药理及毒理分析、药代动力学、生物等效性、临床试验、药物评审、药物制造质量管理等领域广泛使用。借鉴国外的经验,SFDA药品审评中心近期也正式导入了JMP Clinical,以进一步改进我国的药品审评工作,这将对我国的制药企业乃至整个生命科学行业产生广泛、积极的影响。
JMP Clinical是JMP 产品和SAS产品的完美结合。它由JMP及其专为临床试验数据分析开发的Clinical模块、以及几个核心的SAS程序包组成,既能满足传统用户喜欢编写和运行SAS Code的习惯,又充分发挥JMP交互式可视化数据分析的特性,使数据分析效率(如分析药物临床试验中的不良事件、患者档案等)成倍提高。
此外,JMP Clinical 还完全支持越来越被广泛接受的CDISC临床分析与报告标准,帮助用户组织评审流程,自动进行后台分析和报告,让用户有更多的时间去解释和理解分析结果。它还是目前自身能够理解ADaM数据的首批工具之一,帮助评审员和生物统计学家顺利进入到现代评审环境。
JMP Clinical的用户包括医学评审员,流行病学家、数据监查员,生物统计学家和生物测定学团体等等。
JMP Clinical中专为临床试验数据开发的Clinical模块
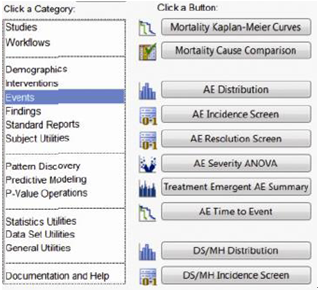
美国Gilead Sciences Inc.公司的统计规划和生物测定部高级总监Steve Wong 先生这样评价JMP Clinical:“很早以前我们就清楚地认识到,JMP Clinical将帮助我们在药物批准流程中获得更快的周转速度。我相信JMP Clinical的确是JMP产品群又一个令人喝彩的精品。”







评论