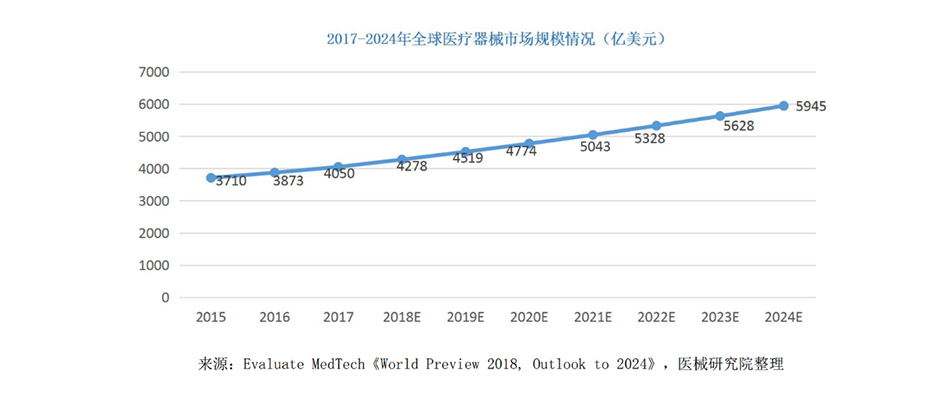
外资医疗器械地位难撼动:国产医械借“技”崛起
技术出错或超前都成难题
本文引用地址:http://www.eepw.com.cn/article/201608/295655.htm技术不仅将很多跃跃欲试的后来者拦在了门外,也可能让一些企业的研发项目增加了胎死腹中的风险。
普罗惠仁是深圳一家研发生产无创治疗设备的公司。其首席创新官黄汉年对本报记者表示,医疗器械尤其是治疗型的医疗器械产品在研发的方向或技术上出错,产品上市或进入临床的时间可能会耽误三五年。
黄汉年补充道,一旦在设计或者方向上出现失误乃至错误,需要重新设计或大幅更改,随之动物实验和临床试验都要从头再来,这样好几年的时间就过去了。“这不像研发手机,今天发现做错了,明天就可以纠正过来。”
普罗惠仁成立于2003年。与大多数的无创治疗设备生产企业不同,它们的无创治疗并非停留在浅表,而是力图透过皮肤与肌肉层直接进入到人体组织的特定部位,实现内脏病变组织的精准治疗,比如说癌症。不过,目前该技术乃至整个行业在国内外均处于起步阶段。
目前,除了专注妇科治疗的子宫肌瘤治疗设备以外,他们也研发出了一款针对胰腺癌以及一款针对肛肠部位肿瘤的治疗设备,目前尚处于临床试验阶段,反馈情况良好。
即便设备和技术超前,新产品入市后企业如何和医院在技术认知上衔接到位,也是一个莫大的挑战。
一位曾在深圳医疗器械行业工作过多年的人士赵明(化名)对本报记者表示,深圳以前有家公司研发出了一款动态心电图监测设备,在全球来说都算是很早的,他们的产品能克服以前静态心电图的弊端。“以前那种静态心电图,人只要一起一坐,心电图就乱了,质量也差,很多异常看不出来。”
这家公司虽然对心电图设备的质量信心满满,但是市场很快给他们泼了一盆冷水。“因为当时的医生看不明白,医生已经习惯了看人在静态时候的心电图。”
临床试验的漫长等待
除了核心技术这个各行业发展的共性问题外,对于普罗惠仁来说,更让他们曾经头疼的是漫长的临床试验。
该公司研发的超声聚焦治疗子宫肌瘤系统临床验证从2008年开始,一直持续到2011年。其间,他们进行了两期临床试验,病症包括子宫肌瘤、子宫腺肌症等多种妇科肿瘤疾病,共1000多个病例。
对于处于初创期的企业来说,漫长的临床试验无疑是个煎熬。除了忐忑不安地等待试验结果,还要不断狠心往里投钱。
黄汉年感慨,项目超级“烧钱”,他们的子宫肌瘤治疗系统的临床试验前后差不多花了4000万元。

对于很多医疗企业来说,从对病症的筛选,到结束治疗后的临床观察,其间每一个环节钱都在哗哗地往外流。如果没有雄厚的资金实力,普通企业弱小的肩膀根本扛不住。
本报记者到访普罗惠仁的时候,正碰到两位投资人走进该司负责人张激的办公室。事后张激颇为自豪地向记者表白“不缺钱”——在创办企业之初他就拉了两个合伙人一起干,一路走来不停地有新股东加入,最多的时候有16位。上个月,当地一家风投注入的1亿元资金也如期到账。
“若市场上已经有同类产品研发出来并销售,那么你去申请人体试验,就有了对照物,需要做的病例就会少很多,很可能只要大半年就能完成试验。”王筱毅解释说,“不过,如果你的产品是全新的,市场上没有先例,那么人体试验持续个两三年太正常不过了。”
得之不易的注册证
王筱毅的企业生产的是诊断设备,此前花了一年的时间才拿到医疗器械注册证。医疗器械注册证(下称“注册证”)是该行业的市场准入“通行证”,拿不到无法上市销售。
我国按照安全性等级把医疗器械分为三类,由不同的药监部门进行审查管理,类别越高,注册审批与管理越严。根据2014年施行的《医疗器械监督管理条例》(下称《条例》)规定,对第二、三类医疗器械实行产品注册管理。
在全球,医疗器械行业都有市场准入的问题。在欧盟必须通过CE认证,在美国是FDA;在中国必须拿到注册证,此外还有生产许可证,不过后者要相对简单很多,主要看制造环节的生产条件和质量管理体系。
由于治疗设备的产品使用风险比诊断设备高出一大截,企业要拿到注册证,一年时间远远不够。
张激所在的普罗惠仁自创办到证件到手,花了八九年。据他介绍,目前全国做他们类似产品的企业,仅有3家拿到该类型治疗设备的注册证,就算在全球来说也不超过五家。
“因为医疗涉及的潜在风险太高,政府主管部门不可能轻易地批准。很多企业即便已做了临床试验,也拿不到这个证。”他说,注册证对临床要求非常高,包括要做多少例的临床、治疗后的相关指标是否达到标准等等。
前期的严格管控,对这些企业来说,是忧,也是喜。一旦产品一路过关进入市场,质量遭市场质疑的可能性就小得多。
由于设备质量过硬,张激的企业在沉寂十年后,已经感受到了市场爆发的力量。
产品自2014年量产后市场迅速打开,去年生产的30多台设备绝大部分进了国内的三甲医院,还有3台出口至韩国。今年他们预计销售额将增长3倍,目前正在加班加点扩大产能。









评论